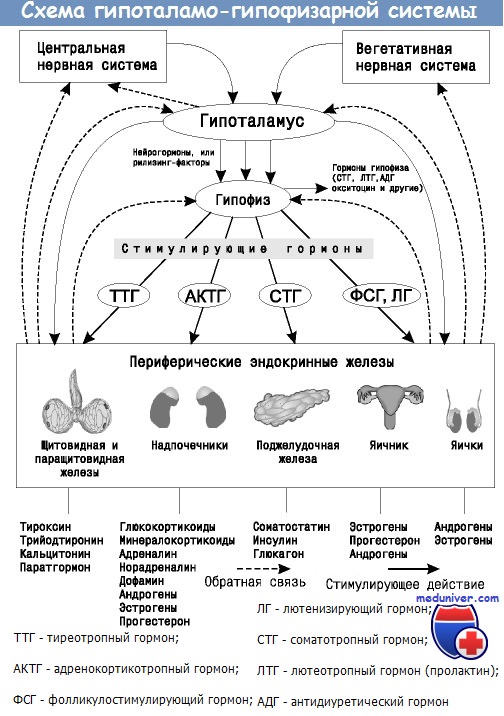
Обмен веществ при задержке развития ребенка
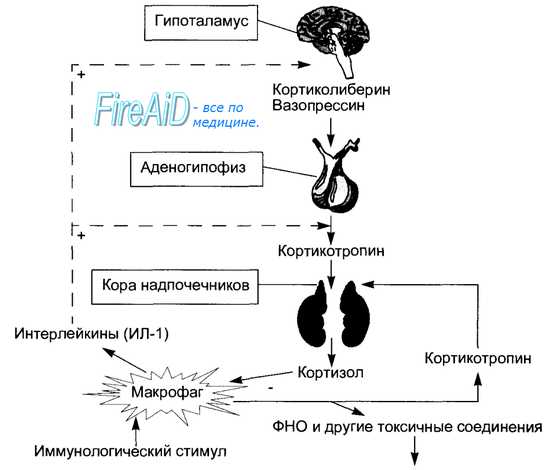
Нарушения эндокринной системы при задержке внутриутробного развития (ЗВУР)Хотя упомянутые проблемы очень важны, не меньшее значение имеют развитие и заболевания головного мозга. Исходя из этого, вопрос, которым задаются родители и врачи, думая о будущем ребенка, звучит так: каким будет неврологический исход? Данные, полученные в проведенных с участием людей исследованиях, показали, что недостаточное питание в раннем возрасте существенно влияет на мозг. Для того чтобы понять механизмы, которые могут быть вовлечены в данный процесс, используют модели на животных. В этой статье на нашем сайте МедУнивер будет обсуждено влияние недостаточного питания на нейроэндокринное перепрограммирование с точки зрения гипоталамо-гипофизарно-надпочечниковой оси (ГГНО). Существует надежда, что изменения в ГГНО могут объединять многие фенотипические эффекты, наблюдаемые в различных органах и системах. Как и в других системах и органах, которые уже обсуждены в данной главе, необходимы значительные усилия исследователей, чтобы отделить влияние перепрограммирования ГГНО на периферические ткани от влияния перепрограммирования периферических тканей на ГГНО. Проблема усложняется выявленной несколькими исследователями связью, которая предполагает, что воздействие высокого уровня глюкокортикостероидов в раннем периоде жизни может вызвать многие из наблюдаемых последствий, сохраняя размытыми различия между причиной и следствием. Разумеется, отправным пунктом является анализ последствий голода в Нидерландах. Rooij и соавт. исследовали выживших детей, которые родились в срок от одноплодной беременности в госпитале Вильгельмины (Амстердам) между ноябрем 1943 г. и февралем 1947 г.. У 60 мужчин и женщин из этой когорты, имевших нормальный уровень глюкозы крови, провели тест с супрессией дексаметазоном и стимуляцией адренокортикотропным гормоном (АСТН1-24). Кроме того, было проведено клиническое обследование и измерены антропометрические показатели. Обследованию были подвергнуты по 10 мужчин и 10 женщин из тех, кто родился до начала голода, во время голода (который определяли как любые 13 нед беременности, в течение которых рацион беременной составлял < 1000 ккал) и после голода. В целом более высокий уровень кортизола после подавления дексаметазоном и более низкий прирост уровня кортизола после стимуляции АСТН1-24 был характерен для мужчин. Как и ожидалось, была положительная корреляция между уровнем кортизола и отношением объема талии к объему бедер, уровнем глюкозы через 2 час и концентрацией инсулина через 2 час. Как сообщают исследователи, при сравнении концентрации кортизола у тех, кто перенес голод, и у тех, кого голод не коснулся, не было существенных различий после теста с подавлением дексаметазоном и стимуляцией АСТН1-24, в том числе в пиковом уровне кортизола, темпе его прироста и площади под кривой. После поправки на возраст, курение и массу тела матери, массу тела ребенка при рождении и социально-экономический статус результаты не изменились. Авторы этого исследования указывают, что выборка была небольшой, а значительный разброс концентрации кортизола затруднил выявление различий. Кроме этого, исследователи отмечают, что перепрограммирование ГГНО может быть более очевидным у лиц с инсулинорезистентностью в отличие от популяции с нормогликемией. Наконец, тест дексаметазон/стимуляция АСТН1-24 позволяет оценить уровень надпочечников в ГГНО, а не ее центральное звено. Результаты этих исследований не исключают возможности перепрограммирования ГГНО в ЦНС.
При внимательном изучении результатов этого исследования можно заметить тенденцию, которая наводит на мысль о постепенном приросте уровня кортизола после введения дексаметазона и пиковом уровне кортизола после стимуляции АСТН1-24, а также постепенном замедлении роста уровня кортизола после стимуляции АСТН1-24 по сравнению с воздействием голода на ранних сроках беременности, в ее середине и на поздних сроках. Тему тендерных различий в перепрограммировании ГГНО продолжают многочисленные публикации. Kajantie и соавт., чтобы доказать перепрограммирование ГГНО, использовали когорту из 7086 человек, родившихся от одноплодной беременности между 1924 и 1933 гг. в университетской клинике города Хельсинки. В подробные отчеты включили массу тела и рост при рождении, массу плаценты при рождении, окружность головы и гестационный возраст. У 421 человека из первоначальной когорты определили уровень кортизола натощак, уровень кортизолсвязывающей способности глобулинов и уровень артериального давления, а также результаты теста на толерантность к глюкозе, принятой per os, и антропометрические параметры. Как и в обсужденных ранее исследованиях, были отмечены общие тендерные различия, в том числе более высокая способность глобулинов к связыванию кортикостероидов у женщин (р < 0,0001) и более высокий уровень свободного кортизола у мужчин (р < 0,0001). Кроме того, у представителей обоих полов обнаружили положительную связь между уровнем общего кортизола и ИМТ в настоящее время (р = 0,003), а также окружностью талии (р = 0,01), положительную связь между показателем свободного кортизола и диастолическим артериальным давлением (р = 0,01), а также уровнем глюкозы (р = 0,02). Что касается характеристик при рождении, то у представителей обоих полов присутствовала существенная положительная связь между ПИ и показателем свободного кортизола (р = 0,02 для мужчин, р = 0,04 для женщин). Уникальной и важной находкой при проведении анализа в подгруппах стал факт, что эта связь имела различия, обусловленные сроком гестации. У детей, родившихся до 39 нед гестации, уровень как общего, так и свободного кортизола отрицательно коррелировал с массой тела при рождении (р = 0,02 и р = 0,09) и ростом (р = 0,001 и р = 0,02). У младенцев, рожденных после 40 нед гестации, уровень как общего, так и свободного кортизола положительно коррелировал с массой тела при рождении (р = 0,06 и р = 0,002) и пондеральным индексом (р = 0,003 и р = 0,003). Для проверки этой взаимосвязи использовали многомерный логистический регрессионный анализ, который показал, что взаимосвязь между массой тела при рождении и гестационным возрастом была статистически значимой (р = 0,01 для общего кортизола, р = 0,003 для свободного кортизола). Другими словами, это исследование показывает, что у взрослых лиц и гипер-, и гипокортицизм может возникать вторично вследствие перепрограммирования, основанного на степени биологической зрелости ребенка при рождении. Эти выводы поддерживают утверждение неонатологов о том, что недоношенные дети отличаются от доношенных, и дают основания сообществу неонатологов проявлять интерес к перепрограммированию, которое, вероятно, происходит в период нахождения новорожденного в ОИТН. Исследования на животных, проведенные до настоящего времени, были сосредоточены на чрезмерном воздействии глюкокортикостероидов на плод при общей убежденности, что это программирует новорожденного на стойкое увеличение активности глюкокорти-костероидных гормонов. Во многих первых исследованиях вводили беременным животным (крысам и овцам) дексаметазон и изучали заболеваемость потомства в постнатальном периоде. Два классических исследования, проведенных в лаборатории Эдинбурга, включают работу Jonathan Seckl, одного из пионеров в этой области. В первом исследовании беременным самкам крыс линии Wistar вводили дексаметазон либо на 1-й, либо на 2-й, либо на 3-й неделе беременности. Введение дексаметазона в течение 3-й недели беременности вызывало у потомства уменьшение массы тела при рождении (р = 0,004) и индуцировало гипергликемию и гиперинсулинемию натощак (р = 0,03). Интересно отметить, что введение дексаметазона на 1-й или 2-й неделе беременности существенно не влияло ни на массу тела при рождении, ни на послеродовой гомеостаз глюкозы. Во втором исследовании беременным самкам крыс линии Wistar вводили дексаметазон на последних неделях беременности, и у потомства, подвергшегося воздействию дексаметазона, присутствовала значительная задержка роста. Вызывает интерес тот факт, что у взрослых животных наблюдались тендерные различия в фенотипе. Для потомства мужского пола, подвергшегося воздействию дексаметазона, было характерно повышение уровня АСТН (р < 0,05), отношения инсулин/глюкоза (р < 0,05) и уровня кортикостерона. Напротив, для потомства женского пола, подвергшегося воздействию дексаметазона, были характерны гипертензия (р < 0,05), повышение в плазме уровня ангиотензиногена и усиление активности ренина. Эти результаты еще раз показывают, что многие фенотипические последствия событий в раннем периоде жизни регулируются по половому признаку. Хотя воздействие на плод пренатального введения стероидов не точно воспроизводит состояние гипогликемии и гипоинсулинизма, которые встречаются у плода с ЗВУР, очевидно, что эти исследования важны для понимания влияния, которое оказывает на плод повышенная активность глюкокортикостероидов. В определении действия глюкокортикостероидных гормонов ключевую роль играют два семейства молекул. Первое семейство — глюкокортикостероидные рецепторы. Хотя они и являются продуктом одного гена, рецепторы, основывающиеся на различных вариантах промотора и экзона, делятся на несколько подтипов. Эти подтипы присутствуют в разных вариантах у человека, мышей и крыс. Несмотря на то что окончательных доказательств пока нет, исследования дают основания полагать, что телеологической причиной этого разнообразия является наличие резерва для специфической для ткани активности в ответ на стресс. Второе семейство — 11b-гидроксистероид-дегидрогеназы (11bHSD). 11bHSD1 функционирует наподобие 11-оксиредуктазы и активирует кортизон, преобразуя его в кортизол. 11bHSD2 функционирует как 11-дегидрогеназа и инактивирует кортизол. В результате 11bHSD2 поддерживает специфичность рецепторов альдостерона, особенно в почках. Экспрессия этих генов была изменена в двух моделях ЗВУР у крыс. В модели задержки внутриутробного развития, вызванной перевязкой маточных артерий, Baserga и соавт. показали, что маточно-плацентарная недостаточность и последующая ЗВУР увеличивают уровень кортикостерона в плазме плода, а также экспрессию генов и активацию глюкокортикостероидных рецепторов в печени. Напротив, ЗВУР в этой же модели вызывала значительное снижение уровня мРНК 11bHSD1 в печени (р < 0,05). Подобным образом модели с дефицитом нутриентов у беременной самки показывают, что недоедание беременной влияет на экспрессию этих двух семейств генов. Например, Bertram и соавт. назначали беременным крысам линии Wistar либо контрольную диету, содержащую 18% казеина, либо низкобелковую диету, содержащую 9% казеина, в течение всей беременности. Как и ожидалось, потомство самок, получавших диету с низким содержанием белка, характеризовалось сниженной массой тела при рождении и повышенным артериальным давлением. С точки зрения уровня глюкокортикостероидных рецепторов уровни мРНК и белка в гене были увеличены в почках в возрасте 12 нед (р < 0,001 для мРНК и белка). Кроме того, у потомства самок, получавших диету с низким содержанием белка, в дальнейшем отмечалось снижение уровня мРНК 11bHSD2 в почках в возрасте 12 нед (р < 0,001). Одним из наиболее интересных результатов этого исследования был факт, что низкобелковая диета приводила к снижению в плаценте уровней мРНК 11bHSD2, не затрагивая уровни мРНК 11bHSD1. Это согласуется с предыдущими сообщениями, в которых указано, что активность 11bHSD2 коррелирует с массой тела при рождении, а также с исследованиями, в которых для уменьшения массы тела при рождении использовали ингибитор 11bHSD карбеноксолон. Важность плацентарной 11bHSD2 затем была подтверждена результатами исследования Holmes и соавт.. В этом исследовании мыши 11bHSD2+/- были скрещены таким образом, чтобы каждая беременная мышь производила +/+, +/- и -/- потомство. Затем этих детенышей сравнили с пометом 11bHSD2+/+ и _//~ спариваний. Вывод из этого исследования был таков: потеря активности 11bHSD2 в фетоплацентарной единице в раннем возрасте приводит к более раннему воздействию материнских глюкокортикостероидов и последующему программированию. Исследования, проведенные с участием людей и на животных, показывают, что предстоит еще многое узнать, однако уже можно сделать вывод, что активность глюкокортикостероидов играет важную роль в фетальном программировании и является его мишенью. Действие глюкокортикостероидов может регулироваться центрально, через ГГНО, или периферически путем разрушения стероидов арома-тазами, а также локально через экспрессию глюкокортикостероидных рецепторов и генов семейства 11bHSD. Это допускает большую специфичность действия этих гормонов, но также усложняет понимание того, является ли наблюдаемое программирование телеологически скоординированным.
– Также рекомендуем “Влияние питания недоношенных новорожденных детей на их болезни в будущем” Оглавление темы “Последствия задержки внутриутробного развития (ЗВУР)”:
|
Источник
Обмен веществ в детском возрасте

Комплексный набор химических реакций называют обменом веществ или метаболизмом (в переводе с греческого «превращение»). Этот процесс длится по определенным этапам: поступление питательных веществ в организм, их всасывание из системы пищеварения, ферментация и расщепление, проникновение в кровь, усвоение и выделение не усвоенных веществ по средствам пота, мочи, кала. Под нарушенным обменом веществ понимают нарушения на одном из уровней биологической системы организма.
Нарушение метаболизма в детском возрасте отличается от такого же процесса у взрослого человека. Развитие детского организма происходит в интенсивном ритме, при этом необходимо большое количество ресурсов и элементов, которые могут вырабатываться только с помощью пищи, попадающей в организм. Высокий метаболизм имеют дети до годовалого возраста. У них идёт формирование основных системных функций. Далее малышу необходимы ресурсы на ассимиляцию и синтез процессов, которые отвечают за развитие и рост.
Из-за нестабильности центральной нервной системы, желез внутренней секреции и нейрогуморальных механизмов, детскому организму крайне сложно регулировать процесс обмена веществ. Именно поэтому нарушение метаболизма в детском возрасте встречается часто. Этому отклонению также способствует отсутствие культуры правильного питания в разумном сочетании с двигательной активностью.
Заболевания у детей при нарушенном обмене веществ
Недостаток белка и железа способствует развитию анемии. Растущий детский организм требует режима в приеме пищи, полноценного питания и реагирует на возможные перегибы в виде вегетарианства появлением анемии. Нехватка фосфора либо кальция, которые являются основными строителями костной системы, особенность организма, препятствующая усвояемости кальция, вызывает рахит. Особенно важна достаточность этих веществ в организме ребенка впервые месяцы.
Сбой фосфорно-кальциевого обмена с переизбытком кальция, обусловленного диагнозом рахит, способствует развитию спазмофилии, основными симптомами которой являются спазмы и судорожный синдром. Нарушенный обмен веществ на уровне физиологии развивает заболевание патологического типа – амилоидоз. При данной болезни поражаются сердечная и почечная мышцы. Гипогликемия, выражается пониженным уровнем сахара в крови по причине стресса или наличии такого же заболевания у матери. Гипергликемия – это следствие сахарного диабета в скрытой форме.
Причины нарушения обмена веществ у детей
Причины нарушения метаболизма в детском возрасте, в основном, относятся к наследственности и окончательно не изучены. Ведущую роль регуляции метаболизма внутри клетки выполняет информация, передающаяся с генами родителей.
Если гены начинают мутацию, особенно те, которые кодируют синтез ферментов, развиваются дефекты обмена веществ. Мутации имеют воздействие на дефекты в генах, отвечающих за транспортировку и структурирование белков.
Диагностика нарушения обмена веществ у детей
Часть болезней при нарушенном обмене веществ диагностируют, проводя обследование сразу после рождения. Более редкие болезни можно выявить у новорожденных либо старших детей, которые относятся к группе риска. Для диагностики применяют стандартные лабораторные исследования, которые имеются в любой поликлинике. Сложные пробы выполняются в специальных лабораториях. Наличие в моче аминокислот, их количество в плазме, определение органической кислоты в моче – эти параметры необходимы для лечения острых и хронических нарушений.
В некоторых случаях необходимо проводить биопсию. Её результаты точно показывают накопление метаболитов аномального типа и помогают правильно поставить диагноз муколипидоз (болезнь Леруа). В диагностике наследственного нарушения обмена веществ уточняющую роль может сыграть обследование неврологического и офтальмологического характера. В последние годы ученые выяснили дефекты генетического уровня, которые являются причиной наследственных нарушений в обмене веществ. С помощью олигонуклеотидных зондов есть возможность точно и быстро определить дефект.
Лечение
Лечение нарушенного обмена веществ состоит из комплекса средств. Оно предполагает постоянный контроль врача. Назначаются гормональные препараты, имеющие в основе биологически активные вещества, нормализующие метаболизм, витамины, участвующие во всех процессах организма. Их употребляют регулярно, в дозах и сочетаниях, указанных врачом.
Ферменты – средства, способные нейтрализовать вязкость гиалуроновой кислоты. Препараты для регулировки гемостаза, аминокислоты и биостимуляторы – средства, дополняющие комплексное лечение наряду с диетическим питанием.

Автор статьи: Мочалов Павел Александрович | д. м. н. терапевт
Образование:
Московский медицинский институт им. И. М. Сеченова, специальность – “Лечебное дело” в 1991 году, в 1993 году “Профессиональные болезни”, в 1996 году “Терапия”.
Наши авторы
Источник