Гипертензивные расстройства во время беременности клинические протоколы
Тактика лечения
ПМСП
После постановки диагноза «Преэклампсия легкой степени» пациентку необходимо направить в учреждение более высокого уровня для уточнения диагноза.
Легкая преэклампсия лечения не требует, только тщательное наблюдение.
Возможно амбулаторное наблюдение, при соблюдении следующих условий:
– пациентка адекватно оценивает свое состояние, выполняет рекомендации врача;
– имеет возможность в любое время обратиться за медицинской помощью.
С признаками тяжелой преэклампсии необходимо начать терапию сульфатом магния и гипотензивное лечение.
Обязательна госпитализация в учреждение III уровня, при отсутствии таковой возможности – в ближайшее родовспомогательное учреждение II уровня машиной скорой помощи после стабилизации состояния на месте.
Стационар
В приемном отделении осмотр беременной с признаками тяжелой преэклампсии проводит врач.
При наличии родовой деятельности или дородовом излитии околоплодных вод беременная должна быть сразу госпитализирована в родовой блок. В зависимости от состояния пациентки акушер-гинеколог совместно с анестезиологом-реаниматологом решает вопрос о госпитализации в профильное отделение (ОПБ, ПИТ). Любая транспортировка пациентки по отделению осуществляются только на каталке.
При сроке беременности до 34 недель беременная с признаками тяжелой преэклампсии без родовой деятельности после начала магнезиальной и гипотензивной терапии также переводится в стационар III уровня.
Родоразрешение является единственным эффективным методом лечения тяжелой преэклампсии.
Показания для досрочного родоразрешения (независимо от срока гестации):
– тяжелая преэклампсия;
– ухудшение состояния плода;
– прогрессирование симптомов преэклампсии.
При сроке беременности 37 недель и более показано родоразрешение независимо от степени тяжести.
Роды через естественные родовые пути предпочтительнее оперативного родоразрешения.
Для индукции родов при незрелой шейке (оценка по Бишопу менее 6 баллов) используется ПГ Е2 или Е1 (интравагинальное введение).
При зрелых родовых путях (оценка по Бишопу более 6 баллов) используется амниотомия, окситоцин.
Метод обезболивания в родах – перидуральная анестезия.
Показания к кесареву сечению при тяжелой преэклампсии являются:
– отсутствие эффекта от проводимого родовозбуждения при не готовых родовых путях;
– преждевременная отслойка нормально расположенной плаценты.
Необходимо тщательное мониторное наблюдение за состоянием плода – длительная или постоянная КТГ и пациентки.
Уход должен осуществляться в безопасной обстановке, то есть женщина не должна оставаться одна.
Предпочтительным методом для обезболивания при оперативном родоразрешении является проводниковая анестезия: спинальная или перидуральная.
Опасности/трудности общей анестезии:
– трудности при интубации из-за отека гортани;
– высокий риск внутримозгового кровоизлияния из-за резкого повышения САД при интубации и экстубации;
– высокий риск отека легких из-за повышения давления в легочных сосудах.
При тяжелой преэклампсии роды должны произойти в пределах 24-48 часов после установления диагноза.
В исключительных случаях, при стабилизации состояния беременной, удовлетворительном состоянии плода, в сроке гестации до 32 недель возможно пролонгирование беременности в учреждениях ВСМП.
Симптоматическое лечение
На настоящее время имеются основания для рекомендации только двух видов симптоматического лечения: противосудорожной и гипотензивной терапии.
Противосудорожная терапия
Магнезиальная терапия является методом выбора для регулирования преэклампсии/эклампсии как наиболее изученная, эффективная и безопасная.
Нагрузочная доза – стартовая доза 5 г сухого вещества сульфата магния (20 мл, 25% р-ра) в/в медленно в течение 10-15 минут.
Поддерживающая доза:
– 1-2 г сульфата магния в час при помощи инфузомата, продолжительность непрерывного в/в введения в течение 12-24 часов;
– при отсутствии инфузомата – на 320 мл физиологического раствора 80 мл 25% раствора сульфата магния, вводить с учетом скорости введения: 11 кап./мин. – 1 г сухого вещества/час; 22 кап./мин. – 2 г сухого вещества/час.
Продолжительность непрерывного внутривенного введения сульфата магния в течение 12-24 часов (1-2 г в час) или (при отсутствии возможности внутривенного введения, в крайних случаях) 10 г сухого вещества по 5 г в каждую ягодицу внутримышечно с 1 мл 2% новокаина или 1 мл 1% лидокаина в одном шприце.
Признаки передозировки сульфата магния являются:
– ЧДД менее 16 в минуту;
– отсутствие или снижение сухожильных рефлексов;
– олигоурия (менее 30 мл/час) повышает риск возникновения передозировки сульфата магния. При наличии олигоурии необходимо более тщательное наблюдение.
При передозировке сульфата магния – прекратить введение препарата и ввести 10 мл 10% р-ра глюконата Са в/в в течение 10 мин.
Гипотензивная терапия
Регулирование артериального давления чаще всего следует начинать при АД 160/100 мм рт.ст. и выше, при этом систолическое давление поддерживать на уровне 130-140 мм рт. ст., диастолическое давление поддерживать на уровне 90-95 мм рт. ст. (из-за опасности ухудшения маточно-плацентарного кровообращения).
Подбор гипотензивных средств – индивидуальный.
Гипотензивные препараты быстрого действия: нифедипин (из группы блокатор Са канальцев) – начальная доза 10 мг (можно сублингвально), повторно через 30 мин. (максимальная суточная доза 120 мг) или натрия нитропруссид (вазодилататор миотропного действия) – начальная доза 0,25 мкг/кг/мин. в/в капельно, увеличивая, при необходимости, дозу на 0,5 мкг/кг каждые 5 мин. до достижения дозы 5 мкг/кг (опасно использовать более 4 часов из-за возможного токсического действия на плод).
Гипотензивные препараты медленного действия: допегит (антигипертензивный препарат центрального действия, метилдопа) – начальная доза 250 мг/сутки, каждые 2 дня дозу увеличивают на 250 мг/сутки.
Ведение в послеродовом периоде
Наблюдение и лечение должно быть продолжено в условиях ПИТа совместно акушером-гинекологом и анестезиологом-реаниматологом.
Магнезиальная терапия должна продолжаться не менее суток после родоразрешения или последнего припадка эклампсии при наличии положительной динамики.
Гипотензивная терапия проводится с индивидуальным подбором лекарственных средств с постепенным снижением доз при стабилизации состояния.
При эклампсии родоразрешение должно произойти не позднее 12 часов от начала судорог.
Помощь во время судорог
Подготовьте оборудование (воздуховоды, отсос, маску и мешок, кислород) и дайте кислород со скоростью 4-6 л в минуту.
Защитите женщину от повреждений, но не удерживайте ее активно.
Уложите женщину на левый бок для уменьшения риска аспирации желудочного содержимого, рвотных масс и крови.
После судорог при необходимости очистите отсосом ротовую полость и гортань.
После приступа немедленно начать магнезиальную терапию.
Нагрузочная доза – 5 г сухого вещества сульфата магния (20 мл 25% р-ра) в/в медленно в течение 10-15 минут.
Поддерживающая доза – на 320 мл физ. р-ра – 80 мл 25% р-ра сульфата магния, вводить в/в с учетом скорости введения:
– 11 кап./мин. – 1 г сухого вещества/час;
– 22 кап./мин. – 2 г сухого вещества/час.
Продолжительность непрерывного внутривенного введения сульфата магния в течение 12 – 24 часов (1-2 г в час).
Назначение седативных средств (диазепама) из-за побочного эффекта (угнетение неонатального дыхания) – нежелательно.
Если судороги повторились через 15 минут, введите 2 г сульфата магния (10 мл – 20%) раствора в/в за 20 минут. Если судороги будут продолжаться, введите диазепам.
Нагрузочная доза – в/в 10 мг диазепама в течение 2-х минут, при возобновлении судорог повторно введите 10 мг диазепама.
Поддерживающая доза диазепама – 40 мг диазепама в 500 мл физиологического раствора в течение 6-8 часов, чтобы женщина могла находиться в седации, но могла быть разбужена.
Прекратить введение поддерживающей дозы диазепама, если ЧДД меньше 16 в минуту.
Возможно ректально введение – 20 мг (4 мл) в шприце без иглы (или в мочевом катетере).
Продолжайте лечение сульфатом магния в течение 24 часов после родов или последней судороги, в зависимости от того, что произойдет последним.
Эклампсия не является абсолютным показанием к срочному родоразрешению.
Необходимо сначала стабилизировать состояние пациентки.
Общий алгоритм
Состояние/ Мероприятие | Хроническая артериальная гипертензия, гестационная гипертензия | Легкая преэклампсия | Тяжелая преэклампсия | Эклампсия |
Тактика | Обследование, наблюдение амбулаторно | Наблюдение, обследование, тщательное наблюдение (возможно, амбулаторно) в течение 7 дней | Активная | |
Госпитализация | – | Для обследования | Обязательная госпитализация в учреждение III-II уровня | |
Специфическая терапия | По показаниям гипотензивная терапия | По показаниям гипотензивная терапия | Магнезиальная, гипотензивная | |
Родоразрешение | – | Родоразрешение в 37 недель. При переходе в тяжелую форму, тактика другая, (см. тяж. форму) | Независимо от срока беременности при тяжелой преэклампсии – в течение 12-24 ч. при эклампсии – в течение 3-12 часов | |
Источник

Гипертензивные расстройства беременных — одна из главных причин материнской и младенческой смертности и возникновения перинатальной патологии. Большинства неблагоприятных исходов можно избежать благодаря назначению своевременной и эффективной профилактики [1].
Уже более 30 лет не утихают споры вокруг профилактики преэклампсии с помощью аспирина — антиагреганта, широко использующегося для профилактики тромбозов. Стремление снизить риск развития тяжелых осложнений беременности всегда сопровождается страхом навредить матери и ребенку чрезмерным вмешательством. На сегодняшний день разработан ряд критериев стратификации риска преэклампсии, позволяющий отбирать кандидатов для профилактики и рекомендовать наиболее эффективную и безопасную для матери и плода тактику [2].
При нормальном течении беременности существует равновесие между тромбоксаном А2 (TXA2 — активатор тромбоцитов и вазоконстриктор) и эндотелиальными простациклинами (PGI2 — ингибитор тромбоцитов и вазодилататор). Это равновесие регулирует агрегацию тромбоцитов и периферическую вазореактивность во время беременности и поддерживает адекватный маточно-плацентарный кровоток [2].
Преэклампсия — вторичное осложнение беременности по отношению к плацентарной дисфункции, которая развивается из-за нарушения ремоделирования спиральных артерий матки на этапе инвазии трофобласта. Постепенно гипоксия плаценты и оксидативный стресс приводят к генерализованной дисфункции ворсинчатого трофобласта, что в свою очередь провоцирует выброс в материнский кровоток факторов (свободных радикалов, продуктов перекисного окисления липидов, цитокинов, sFlt-1), вызывающих генерализованную эндотелиальную дисфункцию. Эндотелиальная дисфункция сопровождается повышенным перекисным окислением эндотелиальных липидов, что активирует ЦОГ и ингибирует простациклин-синтазу, тем самым вызывая быстрый дисбаланс в соотношении TXA2/простациклины (PGI2) в пользу TXA2. TXA2 способствует системной вазоконстрикции, слабо компенсируемой сосудорасширяющим действием простациклинов, уровень которых резко падает [2].
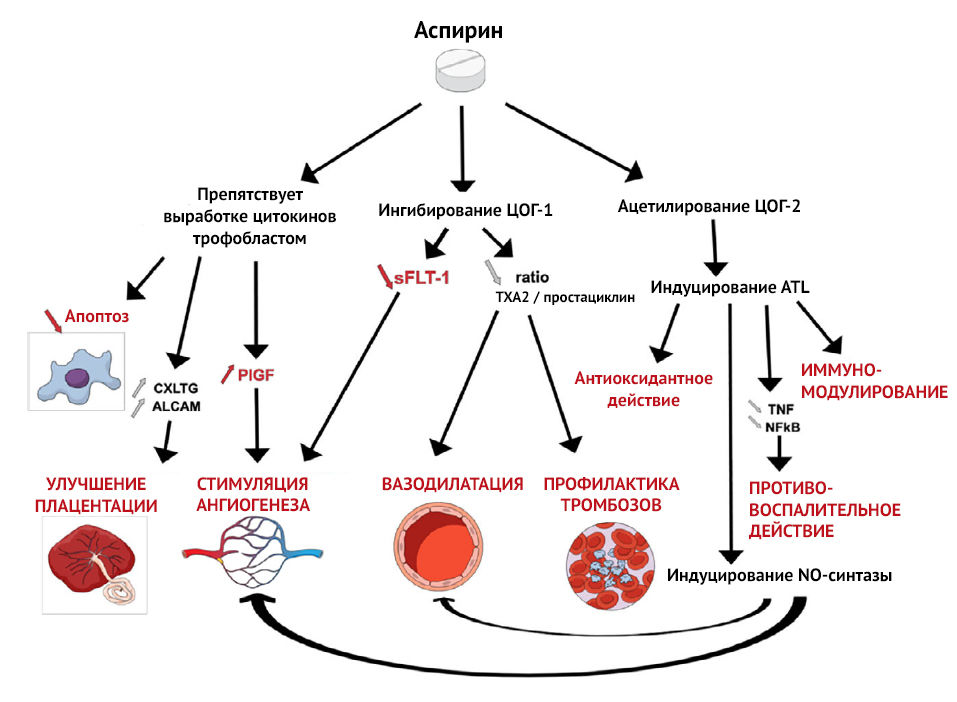
Этот дисбаланс наблюдается с 13 недель беременности у пациенток из группы высокого риска преэклампсии. Баланс TXA2/PGI2 можно восстановить помощью 2-недельного приема низких доз аспирина, который подавляет секрецию TXA2 и, следовательно, агрегацию тромбоцитов, без изменения секреции эндотелиального простациклина (PGI2), тем самым способствуя системной вазодилатации [2].
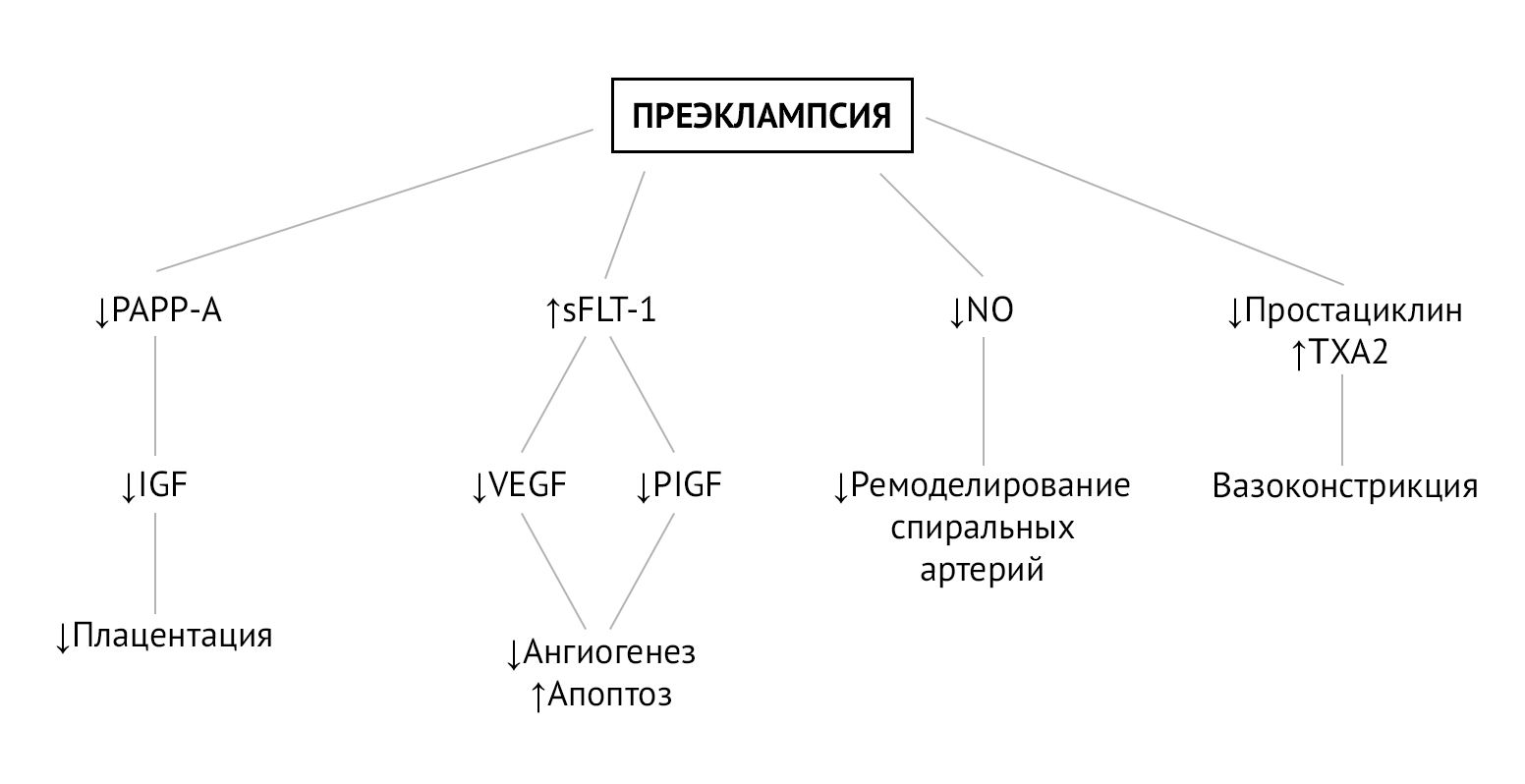
Рисунок 1 | Биомаркеры и патофизиология преэклампсии [3]
На плацентарную гемодинамику также оказывают влияние местные ангиогенные и антиангиогенные факторы. Один из них, Fms-подобная тирозинкиназа-1 (sFlt-1), представляет собой растворимую форму рецептора VEGF, который, связываясь с циркулирующим фактором роста плаценты (PlGF) и фактором роста эндотелия сосудов (VEGF), ведет себя как мощный антиангиогенный фактор. sFlt-1 определяется в больших количествах у пациенток с преэклампсией и ответственен за ангиогенный дисбаланс, наблюдаемый в патогенезе преэклампсии. В условиях гипоксии аспирин подавляет экспрессию sFlt-1 в трофобластах человека и, таким образом, проявляет проангиогенную активность [2].

Рисунок 2 | Механизм действия аспирина [3]
Прежде всего стоит определиться с группами риска преэклампсии, коих выделяют три — «низкий», «средний» и «высокий риск».
К группе высокого риска, согласно рекомендациям NICE, относятся женщины, имеющие в анамнезе гипертензию во время предыдущей беременности или хроническую артериальную гипертензию, хронические заболевания почек, системную красную волчанку, антифосфолипидный синдром, сахарный диабет 1 или 2 типа.
К группе умеренного риска относятся женщины с 2 и более из следующих критериев: первобеременные, возраст 40 лет и старше, интервал между беременностями более 10 лет, ИМТ при первом посещении 35 кгм2 и более, семейная история преэклампсии, многоплодная беременность [4].
На степень риска преэклампсии, по разным данным, также может влиять повышенное среднее артериальное давление до 15 недель беременности, синдром поликистозных яичников, нарушение дыхания во сне и различные инфекции. Что касается акушерского анамнеза, риск повышается в случае вагинального кровотечения во время беременности (продолжительностью не менее пяти дней) и при использовании донорских ооцитов [5].
Однако методы скрининга, основанные на материнском анамнезе, выявляют только 40 % случаев преэклампсии, которые потребуют родоразрешения до 37 недель беременности, что влечет за собой рождение недоношенных детей. В связи с этим разрабатываются системы расчета индивидуального риска преэклампсии с использованием дополнительных критериев [6].
Ультразвуковое исследование дает информацию о состоянии маточно-плацентарного кровотока и плода. Для оценки риска преэклампсии чаще всего используется допплерография маточных артерий с оценкой характера кровотока. Оценка кровотока в пупочной артерии также может выявить предикторы развития ПЭ. Параллельно оценивается состояние плода на предмет гипоксии и задержки развития, а также состояние плаценты и ее кровотока [5, 6, 7].
Среди биохимических маркеров преэклампсии для стратификации риска наиболее широко используется соотношение двух маркеров — фактора роста плаценты (PlGF) и sFlt-1. У женщин с преэклампсией наблюдается более высокий уровень циркулирующего sFlt-1 и более низкий уровень PlGF, что заметно и до начала заболевания [5]. Уровень ассоциированного с беременностью плазменного протеина А (РАРР-А) также используется для расчета риска: клинически значимым будет являться снижение концентрации ниже 0,4 MоM [8]. Мета-анализы описывают потенциальную связь между преэклампсией и повышенными уровнями триглицеридов, холестерина и воспалительных маркеров в сыворотке, включая C-реактивный белок, IL-6, IL-8 и ФНОα [5].
FMF (The Fetal Medicine Foundation) для оценки индивидуального риска преэклампсии предложила комбинировать материнские факторы с показателями среднего артериального давления, индексом пульсации маточной артерии, PAPP-A и PlGF [6, 9].
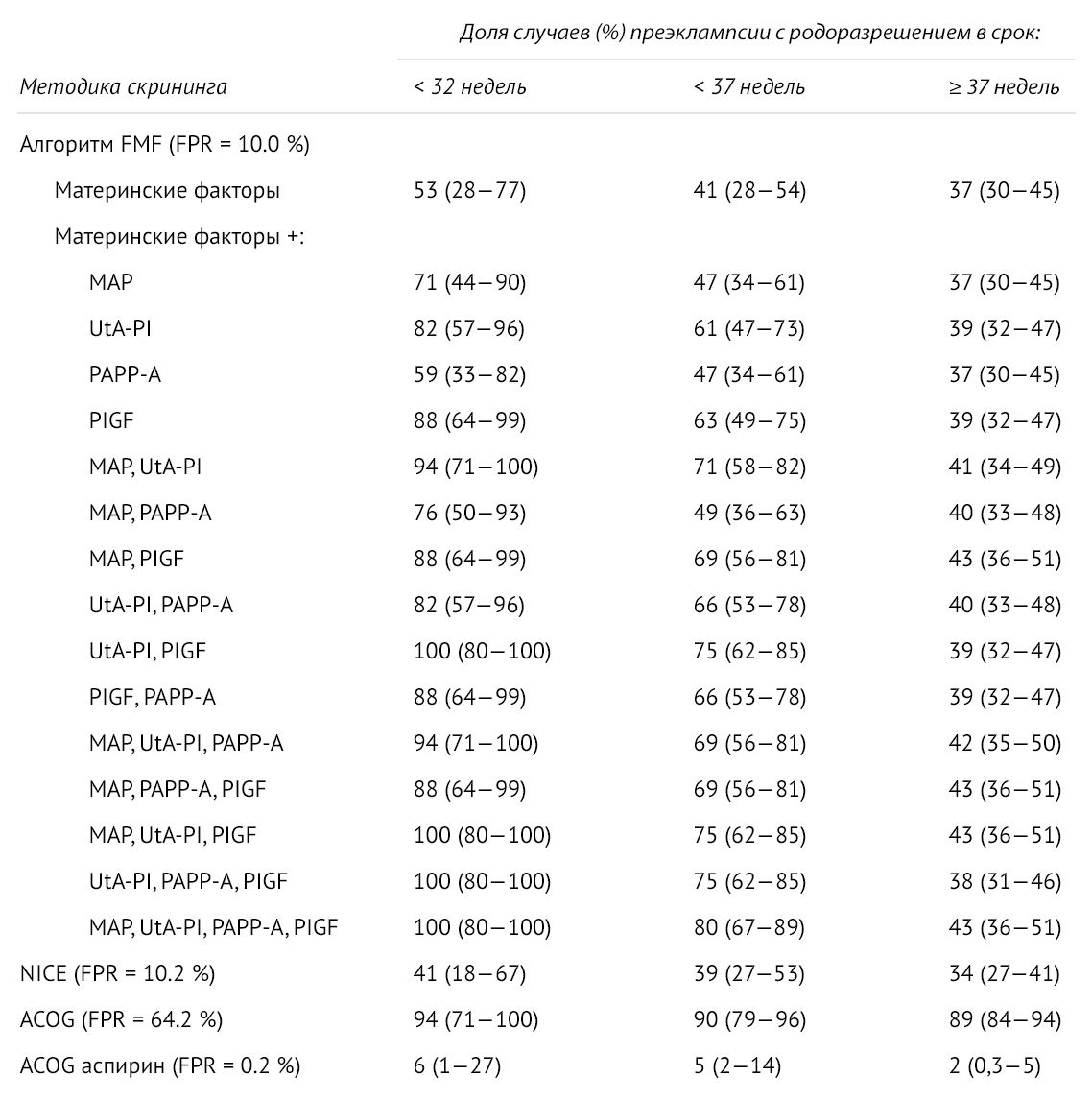
Рисунок 3 | Частота выявления преэклампсии в сроке до 32 недель, до 37 недели, после 37 недели при использовании алгоритмов скрининга FMF, NICE, ACOG и при профилактическом приеме аспирина [9]
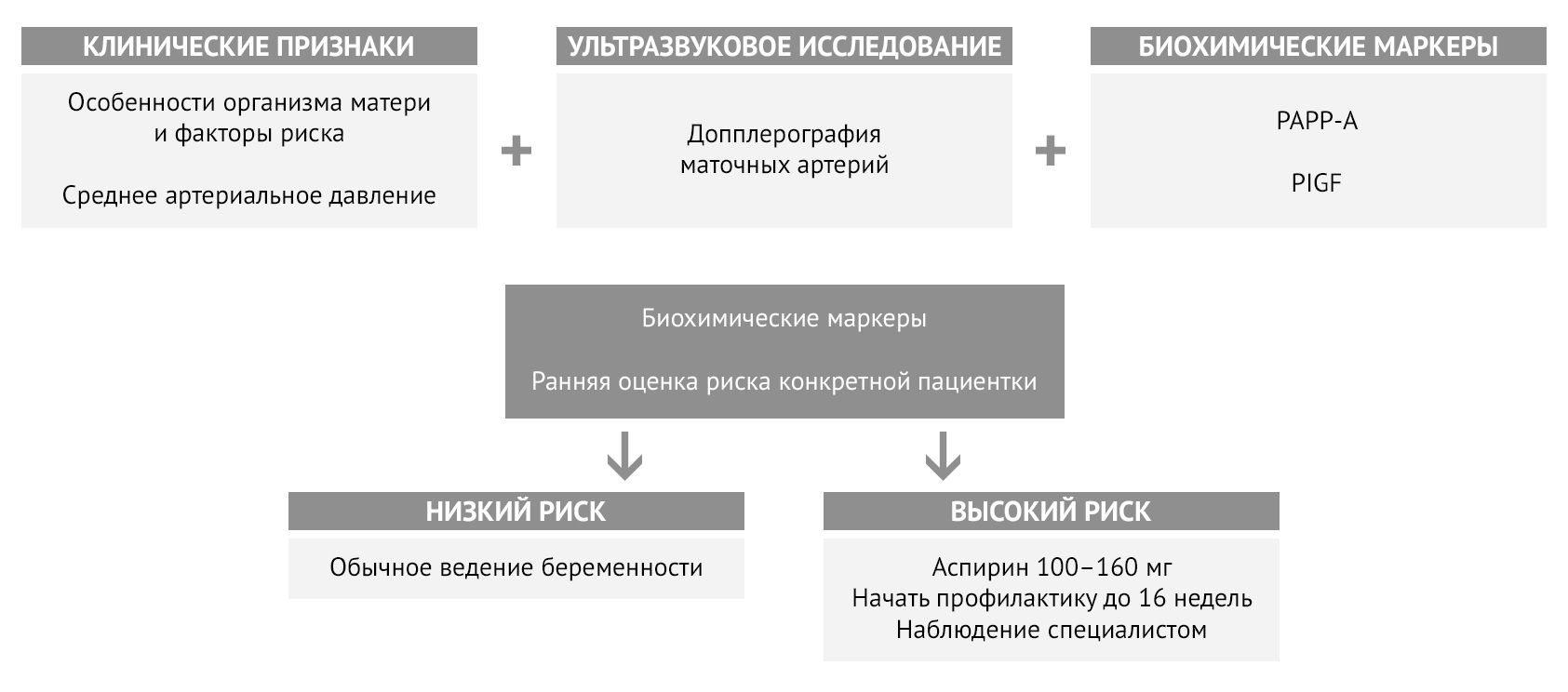
Рисунок 4 | Алгоритм определения индивидуального риска преэклампсии и необходимости профилактики
В 2017 году было проведено исследование ASPRE — комбинированный мультимаркерный скрининг и рандомизированное лечение пациентов аспирином, по результатам которого сделано два важных вывода:
- Профилактический прием аспирина до 16 недель беременности в дозировке 150 мг уменьшает риск развития ПЭ до 34 недели на 82 %, до 37 недели — на 62 %;
- Системы для расчета индивидуального риска, аналогичные предложенной FMF, позволяют выявить 76,7 % беременных, у которых преэклампсия разовьется до 37 недели беременности [10].
Согласно отечественным рекомендациям, аспирин назначается всем пациенткам из группы высокого и умеренного риска после 12 недели беременности и принимается ежедневно вплоть до 36 недели. Дозировка — от 75 до 150 мг в сутки [11].
Все больше исследователей склоняется к тому, что наиболее эффективным является назначение аспирина до 16 недель беременности, а оптимальной дозой — ≥ 100 мг/сут [3, 6, 10, 12].
Раннее начало приема аспирина значительно снижает нежелательные явления у матери и новорожденного. Наиболее вероятное объяснение этих результатов заключается в том, что раннее введение низких доз аспирина улучшает раннее формирование и развитие плаценты [12].
Побочные эффекты, такие как незначительное вагинальное кровотечение и желудочно-кишечные симптомы, наблюдаются примерно у 10 % пациентов. Доказательств повышенного риска серьезного материнского кровотечения или преждевременной отслойки плаценты на данный момент нет [6].
Лечение аспирином приводит к снижению агрегации тромбоцитов плода и, следовательно, к теоретическому риску внутриутробного церебрального кровоизлияния. Этот риск невелик, но число случаев таких побочных эффектов может возрасти при широком назначении аспирина беременным женщинам. Поскольку лечение аспирином следует прекратить примерно на 36 неделе беременности, в зоне риска оказываются дети, рожденные раньше этого срока, следовательно, аспирин может увеличить риск кровотечений, связанных с недоношенностью. Тератогенность, связанная с аспирином, касается только пациенток, получающих дозы от 650 до 2600 мг/сут в связи с заболеваниями сердечно-сосудистой системы. Тератогенного эффекта при приеме аспирина в низких дозах выявлено не было. Негативного влияния на риск развития преждевременных родов и рост плода также не определено, напротив, улучшение маточно-плацентарного кровотока способствует более продолжительной беременности и лучшим показателям роста плода [2].
- Рекомендации ВОЗ по профилактике и лечению преэклампсии и эклампсии. ВОЗ. 2014.
- Atallah A. et al. Aspirin for prevention of preeclampsia //Drugs. – 2017.
- Loussert L. et al. Aspirin for prevention of preeclampsia and fetal growth restriction //Prenatal Diagnosis. – 2020.
- NICE «Hypertension in pregnancy: diagnosis and management» 2019. URL:https://www.nice.org.uk/
- Fox R. et al. Preeclampsia: risk factors, diagnosis, management, and the cardiovascular impact on the offspring //Journal of clinical medicine. – 2019
- Wertaschnigg D. et al. Evidence-Based Prevention of Preeclampsia: Commonly Asked Questions in Clinical Practice //Journal of pregnancy. – 2019.
- Velauthar L. et al. First‐trimester uterine artery Doppler and adverse pregnancy outcome: a meta‐analysis involving 55 974 women //Ultrasound in Obstetrics & Gynecology. – 2014.
- Conde-Agudelo A., Romero R., Roberts J. M. Tests to predict preeclampsia //Chesley’s hypertensive disorders in pregnancy. – Academic Press, 2015
- O’Gorman N. et al. Multicenter screening for pre‐eclampsia by maternal factors and biomarkers at 11–13 weeks’ gestation: comparison with NICE guidelines and ACOG recommendations //Ultrasound in Obstetrics & Gynecology. – 2017.
- Rolnik D. L. et al. ASPRE trial: performance of screening for preterm pre‐eclampsia //Ultrasound in obstetrics & gynecology. – 2017.
- Клинические рекомендации (Протокол лечения) «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия». 2016.
- Cui Y., Zhu B., Zheng F. Low-dose aspirin at≤ 16 weeks of gestation for preventing preeclampsia and its maternal and neonatal adverse outcomes: A systematic review and meta-analysis //Experimental and therapeutic medicine. – 2018.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
